カミボーさんの憶測と願望の域・・・
気になります
夜タイムなので
果てしなく妄想します^^
投資の参考になりましたか?
パソコン版の掲示板ページをリニューアルし、見た目や機能を一部変更しました。
下記リンクから以前の掲示板もご利用いただけます。
直近1週間でユーザーが掲示板投稿時に選択した感情の割合を表示しています。
カミボーさんの憶測と願望の域・・・
気になります
夜タイムなので
果てしなく妄想します^^
投資の参考になりましたか?
武田さんの話題出てますが
エメンドHPに立ち上げパートナ―?として
武田さんのロゴ入ってますよね
希少疾患に力入れているようで
気になってます^^
投資の参考になりましたか?
流石ですねHikiyoseさん✨️
でももう一つあるんですよね…裏のメッセージ
あくまでも私の勝手な憶測と願望の域…✨️
投資の参考になりましたか?
武田のIRより
申請2026年1月6日
受理2026年3月2日
rusfertideはFDAより、ブレークスルーセラピー、希少疾病用医薬品(オーファンドラッグ)およびファストトラックの指定を受けています。
投資の参考になりましたか?
第10号議案 株主提案議案 森下竜一氏との縁切り
投資の参考になりましたか?
それは早かったですね
さすがファストトラック(^^♪
そうするとコラテも2ヶ月程度が十分に見込めそうですね(^^ゞ
投資の参考になりましたか?
非常に多いといっても全部 一人の大株主の方が提案されたようですよ
議案書に原文そのまま載ってます
投資の参考になりましたか?
✨👴だやまマン✨の理想郷やろな✨笑✨😄✨
✨👴だやまマンよ、大いに喜んでくれたまえ✨🖐😄✨🎶
投資の参考になりましたか?
いえねアタシもそう思うんですがwww
下がった日に行使が有ったと騒ぎ立てる人がたくさんいるので、アタシが知らないだけで行使があったのを知る方法があるのかと思いまして(^^ゞ
投資の参考になりましたか?
>武田がFDAに「ルスフェルチド」の承認申請を提出し受理されました。
申請してから受理されるまでに2か月かかるんだ。
投資の参考になりましたか?
新任役員の平均年齢が高すぎてダーヤマが違和感無いね。
投資の参考になりましたか?
武田がFDAに「ルスフェルチド」の承認申請を提出し受理されました。
審査終了目標は7~9月とのこと、優先審査の為、異例の速さです。
コラテジェンも、今年中に申請が受理されれば、来年夏ごろには承認されそうですね。
2年待たなくてもいいかも。
投資の参考になりましたか?
AIですか
どんなプロンプトを投げた結果ですか(^^ゞ?
投資の参考になりましたか?
ネタバレしますね^^
新任予定の話しです
国際金融界
薬事承認
日米会計監査から
すんごい方が来られます
どこの話しだ
アンジェスだ
なにやら本気の期待大
※カミボーさんのコメントで気付きました
またまたカミボーさん 神^^☆
投資の参考になりましたか?
YES‼www
投資の参考になりましたか?
その通りです
等価交換、過不足なく
成すべき事それに見合うだけの能力は求められます(^^ゞ
投資の参考になりましたか?
ご安心ください
ワラントの追加程度であれば発行可能株式数を増やすまでもなく対処できる現状です(^^ゞ
投資の参考になりましたか?
信用買い応援団は、
これからどうするのかな?
資金力ある団体見つけてるのかな?
今年、 面白そうだねwww
投資の参考になりましたか?
アンジーまた2,000円になってね
大阪発のワクチン失敗で
数千万円が熔けたんですけどなんとかしてー
投資の参考になりましたか?
ヒマ人のサロンだからね。
一日中40回も60回も書込む
お侍さんは一番のヒマ人かもね
投資の参考になりましたか?
今気づいた 役員報酬 そら要るわなぁ・・・
逆に有難う
敬意を込めて^^☆
投資の参考になりましたか?
ご自由にどうぞ
判断は人それぞれ自己責任ですから(^^ゞ
投資の参考になりましたか?
ご安心ください
ワラントの追加程度であれば発行可能株式数を増やすまでもなく対処できる現状です(^^ゞ
投資の参考になりましたか?
んで株主提案議案ですか
一人の大株主の方が提案されたようで原文そのままが議案書に載ってましたね
内容は確認されてましたか(^^ゞ?
投資の参考になりましたか?
第25回日本再生医療学会総会が2026年3月19~20日に神戸国際会議場・神戸国際展示場で開催されます。
続けて21日には、国際細胞遺伝子治療学会(ISCT)とのジョイントシンポジウムも開催。
本総会は日本再生医療学会では初めて、企業が主催を務めるという点でも大きな注目を集めています。
だそうです^^
投資の参考になりましたか?
まさかの見てないのの発言?
と考えたら
おかしくなりました
すみません
投資の参考になりましたか?
✨ノンホルダー✨は、損失も利益もありません✨😄✨
✨大いに楽しんでいる事は、間違いありません✨笑✨😄✨
投資の参考になりましたか?
factaですか あれ有料契約制なんで内容分からないんですよね(^^ゞ
具体的にどんな事が書かれていたのですか?
投資の参考になりましたか?
大政奉還前夜の様相だな。
ナマポ申請すんなよ
投資の参考になりましたか?
互いに大いに楽しみましょう✨笑✨🖐😄✨
投資の参考になりましたか?
今日は虫リストが少ない。
日経下げ過ぎで、てんてこ舞いみたいね(^^♪
投資の参考になりましたか?
おじさん、足元燃え盛ってまふよ。
投資の参考になりましたか?
ですね…
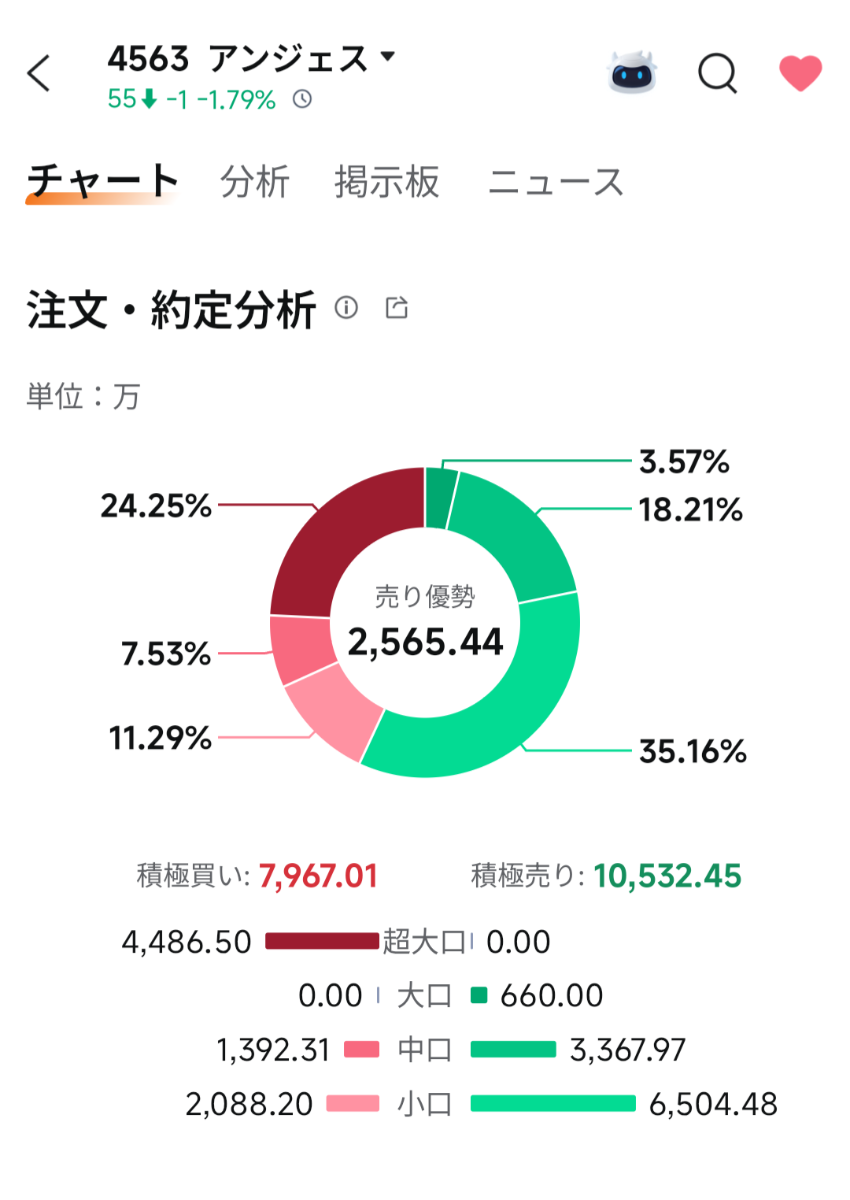
投資の参考になりましたか?
なるほどなるほど…
投資の参考になりましたか?
日々の上げ下げに一喜一憂した
ってしょうがないよ、
掲示板でいくら書込んでも
コラテの成否には何の影響力も
ない。
信じるなら放っておけばいいし
信じないなら売ればいい。
必死に応援したって否定したってなんの影響力もないでしょ。
投資の参考になりましたか?
虫籠とか言うやつに入れればイイやん。
投資の参考になりましたか?
批判者??
ナウイな。
投資の参考になりましたか?
役員報酬を
なんか違う解釈されてんですかね
投資の参考になりましたか?
やはり面白くないので 緑はポイします^^
ごめんね
あなたはただの批判者
ばいばい
投資の参考になりましたか?
大変失礼な事をお聞きするのですが、
タイガースの
4番 中谷
5番 福留
をご存じでふか?
投資の参考になりましたか?
2,492円は6月ですね。
どうでもいいですが。
投資の参考になりましたか?
大変失礼かと存じますが
変態ですか?
投資の参考になりましたか?
大変失礼な事をお聞きするのですが、
脳梅○を患っておられますか?
投資の参考になりましたか?
損切りはしない。本日追加4000株追加しました。
楽しみが増えました。
投資の参考になりましたか?
えええ??!れ!!!れれれのれーー
!
役員報酬含めてーー!!
失礼なのですが、
ア○ですか?
投資の参考になりましたか?
色々な考えがあると思いますが・・・
役員報酬含めアンジェス 私は応援します
投資の参考になりましたか?
2026.3.4アンジェス株価の終値は55円です✨😄✨
6年前、3月某日アンジェス株価は2,492円でしたな✨笑✨😄✨
✨諸行無常✨と存じます✨😄✨🎶
「諸行無常」は日本の文化に深く浸透しており、『平家物語』の冒頭「祇園精舎の鐘の声、諸行無常の響きあり」は特に有名です。また、『方丈記』にもこの思想が反映されていますな✨😄✨🎶
投資の参考になりましたか?
ホルダーさん 江
総会に出席ならまず高額役員報酬を見直すこと、発行株数
の7億株から12億株への拡大をやめること。
この2点を主張しては、どれも株主軽視ではないだろうか。
*だから今回の株主提案で、役員報酬の個別開示を求めている
投資の参考になりましたか?
6年前、3月某日アンジェス2,492円
今日55円✨😄✨
確かに頑張ってますな✨笑✨😄✨
投資の参考になりましたか?
論文・ダウンロード数
ついに < 300件数 >を超えて突破しました。
本当に凄い!ことです。
関係医療からの、注目度がいかに高く、崇高であることかの証左を表示しています。
しかも、日々増加しています。 コラテジェンの期待度の高さです。
一日も早く、病める患者さんへ、お届けしたいものです。
・・・・
245件 1/30 18:14
249 2/1 06:09
253 2/3 07:06
259 2/4 20:53
265 2/6 20:00
276 2/15 04:05
284 2/20 19:18
290 2/24 21:19
296 2/26 19:00
297 3/1 7:42
302 3/2 17:50
アンジェス記事ストック IB4さん寄稿 より ありがとうございました。
投資の参考になりましたか?
クレイワークさん こんにちは
そしてありがとうございます
今回は少し控えめに務めたつもりですが・・・
一応ですね どこの銘柄を持っていても
今回の下げは ある意味仕方ないという想いを込めました
投資の参考になりましたか?
投資の参考になりましたか?
50円まで売らせたい感じ。
いい加減な株主軽視の会社?
米国で承認され相みたいなこと言って早1年?
買う人もいるのね。私も〇鹿です
投資の参考になりましたか?
今日の下げ歴代3位に入りそう
2024年8月5日:4451円
1987年10月20日3,836円
(ブラックマンデー翌日)
2024年8月2日:2216円
アンジェス頑張っていると思う
頑張れアンジェス^^☆
投資の参考になりましたか?
総会に向けて
ゆっくり買い増ししますわ🤗
投資の参考になりましたか?
私が何を言っているか
貴方は分かるはずですね☆
投資の参考になりましたか?
55円には落ちないと思っていたけど、他の銘柄で追証になって泣く泣く損切りした人がいるのかな?
投資の参考になりましたか?
あなたの行動を調べられる方が
困るとと思いますよ^^
投資の参考になりましたか?
factaの記事が真実なら上廃もおかしくないよね
それで調べられても困るから株主提案議題全て反対なのかな
外部の人間が入られるの余程困るんだろうね
投資の参考になりましたか?
そんな事をわざわざ言いに来られる時点でおかしい
そう感じます
理解の上で応援しています
投資の参考になりましたか?
大赤字会社の社長が
高額報酬をもらっている時点でおかしい
結局ダー山の小遣い
投資の参考になりましたか?
会社が大事な社長なら
自社株持っているでしょ
ダー山に聞いてみて下さい
微塵も持っていませんから
投資の参考になりましたか?
ダー山が居なければ
出来る
投資の参考になりましたか?
いつぞや108円で1,000株…
どうしたもんでしょか~w
投資の参考になりましたか?
買収対策として新株予約権の無償割当(1:1)を行うためには7億株では不足するための枠拡大につきやむを得ない。ただ買収話は無用な心配となることを願う。
投資の参考になりましたか?
何故 何故なの?
投資の参考になりましたか?
55 で5000株 inしました。
はよ500!いって
投資の参考になりましたか?
1億株70億円(46回ワラント)をばらまき、希薄化に拍車をかけるより
米大手製造販売企業に買収してもらい、資金調達と技術の共同支援により
HGF遺伝子治療薬の完成を急いでもらいたいと思う
投資の参考になりましたか?
良い物は下がらないと思うけど せめて3桁は有って欲しいなーブヒ🐽ブー
投資の参考になりましたか?
ひな祭り終わったら、、
怪板の100万5段飾り 消えたw
粋な演出だったね 笑
投資の参考になりましたか?
今日のように全体が大きく下げる日は
見方によってはチャンスの日でもありますね
そんな日に不安煽りしている方
不思議に思う
良い銘柄あるじゃん
強い言葉で自身あるなら買いに行けばいいのに
そう感じます☆
投資の参考になりましたか?
しかし先程の動きは日経に連続していたね。
55円で買ったが、そろそろ底値だといいな。
投資の参考になりましたか?